2024. 04
活動期間: 2024.04.22 -
康霈新藥CBL-514橘皮組織二期試驗成功達標,50%以上受試者橘皮組織用藥後改善至少一個等級
2024年4月22日 – 康霈生技(6919-TW)旗下新藥CBL-514注射劑經美國食品藥物管理局(U.S. FDA)核准用於改善大腿中/重度橘皮組織之兩階段二期臨床試驗(CBL-0201EFP 2 stage-Phase 2 Study)已取得最終臨床統計數據結果。結果顯示,本試驗主要與次要療效指標在ITT群體與PP群體分析皆達臨床及統計上顯著意義,可顯著改善橘皮組織。此外,CBL-514藥物安全性與耐受度良好,不但不會有目前上市產品治療後嚴重瘀傷或其他明顯副作用,在CBL-514治療後超過5成的受試者橘皮組織可改善一個等級以上,高達95%以上受試者之大腿橘皮組織顯著改善。
CBL-514注射劑是全球首創的505(b)(1)全新小分子新藥,其專一性促進脂肪細胞凋亡機轉,可精準減少皮下淺層脂肪而達到改善橘皮組織的凹凸不平之療效,是全球首創針對減少橘皮組織的突起部位脂肪來治療橘皮組織的產品。
CBL-514三劑量組別皆能改善橘皮組織,並以高劑量80mg療效最佳
CBL-0201EFP試驗為一項於美國執行、多中心、開放標籤之二階段二期臨床試驗,共納入35位大腿具有中/重度橘皮組織之受試者,以 修正後Hexsel橘皮嚴重程度量表(Modified HCSS 註)評估CBL-514治療後之療效,與安全性。
第一階段試劑量篩選試驗納入了12位受試者平均分派入低劑量組40mg、中劑量組60mg及高劑量組80mg三個組別,每位受試者兩側大腿各給與一次CBL-514治療,並於治療後1週、2週及4週追蹤療效與安全性。
臨床統計結果顯示,三劑量組別在一次 CBL-514 治療後2週與4週,其橘皮組織嚴重程度總分相較於治療前皆明顯降低,顯示三組別皆能顯著改善橘皮組織嚴重程度;其中又以高劑量組別80 mg的療效最佳,與治療前相比,CBL-514一次治療後2週與4週,橘皮組織嚴重程度總分可分別減少(mean±SD):-2.0±0.9 (p=0.00049,95%CI: -2.77, -1.23) 和 -2.6±1.5 (p= 0.00169,95%CI: -3.88, -1.37)。
超過5成受試者之橘皮組織於治療後12週達至少一個等級改善
第二階段單一劑量組試驗納入了23位受試者,根據大腿橘皮組織嚴重程度給與最多2次、單次劑量不超過320mg之CBL-514注射,並於最後一次治療後4週與12週評估療效與安全性。
主要療效指標之統計結果顯示,在治療前,受試者之大腿橘皮組織嚴重程度平均分數為6.5±1.0分,而在接受CBL-514最後一次治療後第4週,大腿橘皮組織嚴重程度平均分數變化(mean±SD)為-1.3±1.3分 (p<0.00001,95%CI: -1.70, -0.90),顯示CBL-514治療後可顯著降低橘皮組織嚴重程度,療效在臨床與統計上皆達到顯著有效意義。
試驗結果顯示CBL-514治療後4週與12週皆可顯著降低橘皮組織嚴重程度,療效在臨床與統計上達到顯著有效意義(p< 0.00001),其中超過5成的受試者之橘皮組織嚴重程度於治療後的12週可達到至少一個等級的改善。此外,利用Global Aesthetic Improvement Scale(GAIS) 評估治療後橘皮組織改善情況,在治療後第4週,臨床試驗主持人(PI)與受試者評估結果皆顯示,治療後超過95%受試者之橘皮組織有改善。
綜合以上臨床統計結果,CBL-0201EFP Phase 2兩階段試驗皆展現CBL-514在橘皮組織嚴重程度改善之療效顯著,且藥物安全性與耐受度表現良好。多數不良事件(adverse events)為輕度和中度之注射部位反應,例如注射部位紅、腫、溫、痛、瘀青及搔癢等,並多可在注射後28天內完全緩解。
本公司接下來將依美國食品藥物管理局之建議,為CBL-514在未來橘皮組織治療之臨床試驗進行開發與確校「橘皮組織嚴重程度評量表」,以用於橘皮組織治療療效之評估。本公司也將於2024年4月29日下午3:00召開本試驗完整數據線上法說會,詳細說明臨床統計結果。
註:本試驗採用修正後 Hexsel橘皮嚴重程度量表(modified HCSS)針對受試者治療部位在治療前、後進行橘皮組織嚴重程度評分,藉以評估CBL-514注射劑改善中/重度橘皮組織的療效。Modified HCSS總分為9分,分數愈高代表橘皮組織嚴重程度較高,並依分數分為四個嚴重程度等級,如下表所示: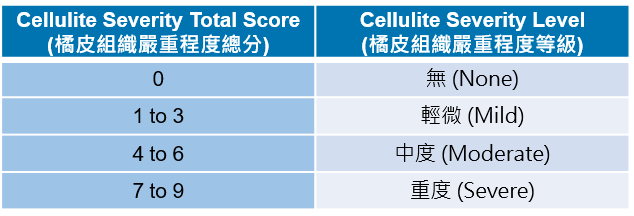
關於橘皮組織治療現況
根據美國整形外科醫學會(American Society of Plastic Surgeons, ASPS)的資料指出,美國約有80%到90%的女性有橘皮組織的困擾。然而,現有的橘皮組織治療產品(包含醫療設備或去氧膽酸注射劑、QWO注射劑等)療效仍然有限且難以預測、具有中度侵入性並伴隨著術後嚴重、明顯的副作用,如嚴重瘀傷、疼痛或色素沉澱等。其中,唯一經美國FDA核准可用於橘皮治療之注射劑QWO已於2022年12月因嚴重色素沉澱等副作用而停止販售。
根據Future Market Insights的報告預估2034年全球橘皮治療市場規模將達到73.7億美元,但若革命性的治療橘皮組織的藥品問世,潛在未滿足的市場將逐漸被開拓。
關於CBL-0201EFP 2 stage-Phase 2 臨床試驗
CBL-0201EFP二期臨床試驗為經由美國食品藥物管理局(U.S. FDA)核准執行之多中心兩階段二期臨床試驗,試驗目的為評估CBL-514注射劑改善中/重度橘皮組織之療效與安全性。
試驗第一階段CBL-0201EFP Phase 2-stage 2, clinicaltrial.gov ID: NCT05632926)為一項開放標籤、劑量篩選之二期臨床試驗,一共納入12位受試者,採單一劑量遞增(Single ascending dose)方式收案,並分為3個CBL-514劑量組別,每個劑量組別納入4位受試者,分別為低劑量組40mg(1.0mg/cm2)、中劑量組60mg(1.5mg/cm2)及高劑量組80mg(2.0mg/cm2)。每位受試者兩側大腿給與一次之CBL-514治療,三組劑量組別之大腿注射總面積合計皆為40平方公分,並於治療後1週、2週及4週追蹤療效與安全性。
試驗第二階段(CBL-0201EFP Phase 2-stage 2, clinicaltrial.gov ID:NCT05836779)為一項開放標籤、單一劑量組別之二期臨床試驗,一共納入23位受試者,根據大腿橘皮組織嚴重程度最多給與2次、治療總劑量80mg至320mg之CBL-514注射(2.0mg/cm2),兩側大腿注射總面積合計不超過160平方公分。注射間隔為4週,並於最後一次注射後4週與12週評估療效與安全性。
CBL-514 產品研發現況
CBL-514注射劑是全球首創的505(b)(1)全新小分子新藥,透過誘導脂肪細胞凋亡來減少注射部位脂肪。CBL-514為一多適應症之首見新藥(First-in-class),包含非手術局部減脂(non-surgical fat reduction)、罕見疾病竇根氏症(Dercum’s disease)及中/重度橘皮組織等適應症。
CBL-514 在醫美-非手術局部減脂 (減少皮下脂肪),已於澳洲與美國完成Phase 1、Phase 2a、CBL-0202 2 Stage Phase 2以及最大劑量代謝物鑑定MetID Phase 2臨床試驗(CBL-0203 Phase 2),並皆已取得臨床統計結果。根據上述已完成的臨床試驗結果,CBL-514可明顯減少治療部位皮下脂肪,療效達顯著統計差異(p<0.00001),且單次治療即可顯著減少治療部位皮下脂肪(p<0.00001),並可在2週內看到治療效果,且治療劑量達800 mg其藥物安全性與耐受度依然良好; CBL-0204 Phase 2b臨床試驗已於美國與澳洲完成收案,預計將於2024Q2完成試驗;CBL-0205 Phase 2b 臨床試驗已於2023年10月開始收案,預計將於2024Q3完成試驗;全球多國多中心CBL-0301 Phase 3樞紐試驗IND已於2024年1月取得澳洲HREC核准執行。
CBL-514治療罕見疾病竇根氏症之CBL-0201DD Phase 2臨床試驗已於2023年4月完成試驗,其主要療效指標與次要療效指標在ITT與PP皆達到臨床及統計上顯著有效意義(p<0.0001);CBL-0202DD則預計於2024Q2開始收案。
CBL-514改善中/重度橘皮組織之CBL-0201EFP Phase 2-Stage 1已於2023年5月完成試驗並已取得療效初步統計結果,CBL-0201EFP Phase 2-stage 2已於2024年1月完成試驗,並於2024年4月取得臨床統計結果,其主要療效指標與次要療效指標在ITT與PP皆達到臨床及統計上顯著有效意義(p<0.0001)。
聲明
本文章及網站中所發佈之相關資料含有預測性敘述,此類敘述是基於現況的預測和評估。這些預測性敘述將受不確定性、風險與其他非本公司所能掌控等因素影響。惟仍存有許多因素可能使事件的發展或其實際結果與預測性敘述有重大差異。本公司不負任何更新或修訂之責任。
CBL-514注射劑是全球首創的505(b)(1)全新小分子新藥,其專一性促進脂肪細胞凋亡機轉,可精準減少皮下淺層脂肪而達到改善橘皮組織的凹凸不平之療效,是全球首創針對減少橘皮組織的突起部位脂肪來治療橘皮組織的產品。
CBL-514三劑量組別皆能改善橘皮組織,並以高劑量80mg療效最佳
CBL-0201EFP試驗為一項於美國執行、多中心、開放標籤之二階段二期臨床試驗,共納入35位大腿具有中/重度橘皮組織之受試者,以 修正後Hexsel橘皮嚴重程度量表(Modified HCSS 註)評估CBL-514治療後之療效,與安全性。
第一階段試劑量篩選試驗納入了12位受試者平均分派入低劑量組40mg、中劑量組60mg及高劑量組80mg三個組別,每位受試者兩側大腿各給與一次CBL-514治療,並於治療後1週、2週及4週追蹤療效與安全性。
臨床統計結果顯示,三劑量組別在一次 CBL-514 治療後2週與4週,其橘皮組織嚴重程度總分相較於治療前皆明顯降低,顯示三組別皆能顯著改善橘皮組織嚴重程度;其中又以高劑量組別80 mg的療效最佳,與治療前相比,CBL-514一次治療後2週與4週,橘皮組織嚴重程度總分可分別減少(mean±SD):-2.0±0.9 (p=0.00049,95%CI: -2.77, -1.23) 和 -2.6±1.5 (p= 0.00169,95%CI: -3.88, -1.37)。
超過5成受試者之橘皮組織於治療後12週達至少一個等級改善
第二階段單一劑量組試驗納入了23位受試者,根據大腿橘皮組織嚴重程度給與最多2次、單次劑量不超過320mg之CBL-514注射,並於最後一次治療後4週與12週評估療效與安全性。
主要療效指標之統計結果顯示,在治療前,受試者之大腿橘皮組織嚴重程度平均分數為6.5±1.0分,而在接受CBL-514最後一次治療後第4週,大腿橘皮組織嚴重程度平均分數變化(mean±SD)為-1.3±1.3分 (p<0.00001,95%CI: -1.70, -0.90),顯示CBL-514治療後可顯著降低橘皮組織嚴重程度,療效在臨床與統計上皆達到顯著有效意義。
試驗結果顯示CBL-514治療後4週與12週皆可顯著降低橘皮組織嚴重程度,療效在臨床與統計上達到顯著有效意義(p< 0.00001),其中超過5成的受試者之橘皮組織嚴重程度於治療後的12週可達到至少一個等級的改善。此外,利用Global Aesthetic Improvement Scale(GAIS) 評估治療後橘皮組織改善情況,在治療後第4週,臨床試驗主持人(PI)與受試者評估結果皆顯示,治療後超過95%受試者之橘皮組織有改善。
綜合以上臨床統計結果,CBL-0201EFP Phase 2兩階段試驗皆展現CBL-514在橘皮組織嚴重程度改善之療效顯著,且藥物安全性與耐受度表現良好。多數不良事件(adverse events)為輕度和中度之注射部位反應,例如注射部位紅、腫、溫、痛、瘀青及搔癢等,並多可在注射後28天內完全緩解。
本公司接下來將依美國食品藥物管理局之建議,為CBL-514在未來橘皮組織治療之臨床試驗進行開發與確校「橘皮組織嚴重程度評量表」,以用於橘皮組織治療療效之評估。本公司也將於2024年4月29日下午3:00召開本試驗完整數據線上法說會,詳細說明臨床統計結果。
註:本試驗採用修正後 Hexsel橘皮嚴重程度量表(modified HCSS)針對受試者治療部位在治療前、後進行橘皮組織嚴重程度評分,藉以評估CBL-514注射劑改善中/重度橘皮組織的療效。Modified HCSS總分為9分,分數愈高代表橘皮組織嚴重程度較高,並依分數分為四個嚴重程度等級,如下表所示:

關於橘皮組織治療現況
根據美國整形外科醫學會(American Society of Plastic Surgeons, ASPS)的資料指出,美國約有80%到90%的女性有橘皮組織的困擾。然而,現有的橘皮組織治療產品(包含醫療設備或去氧膽酸注射劑、QWO注射劑等)療效仍然有限且難以預測、具有中度侵入性並伴隨著術後嚴重、明顯的副作用,如嚴重瘀傷、疼痛或色素沉澱等。其中,唯一經美國FDA核准可用於橘皮治療之注射劑QWO已於2022年12月因嚴重色素沉澱等副作用而停止販售。
根據Future Market Insights的報告預估2034年全球橘皮治療市場規模將達到73.7億美元,但若革命性的治療橘皮組織的藥品問世,潛在未滿足的市場將逐漸被開拓。
關於CBL-0201EFP 2 stage-Phase 2 臨床試驗
CBL-0201EFP二期臨床試驗為經由美國食品藥物管理局(U.S. FDA)核准執行之多中心兩階段二期臨床試驗,試驗目的為評估CBL-514注射劑改善中/重度橘皮組織之療效與安全性。
試驗第一階段CBL-0201EFP Phase 2-stage 2, clinicaltrial.gov ID: NCT05632926)為一項開放標籤、劑量篩選之二期臨床試驗,一共納入12位受試者,採單一劑量遞增(Single ascending dose)方式收案,並分為3個CBL-514劑量組別,每個劑量組別納入4位受試者,分別為低劑量組40mg(1.0mg/cm2)、中劑量組60mg(1.5mg/cm2)及高劑量組80mg(2.0mg/cm2)。每位受試者兩側大腿給與一次之CBL-514治療,三組劑量組別之大腿注射總面積合計皆為40平方公分,並於治療後1週、2週及4週追蹤療效與安全性。
試驗第二階段(CBL-0201EFP Phase 2-stage 2, clinicaltrial.gov ID:NCT05836779)為一項開放標籤、單一劑量組別之二期臨床試驗,一共納入23位受試者,根據大腿橘皮組織嚴重程度最多給與2次、治療總劑量80mg至320mg之CBL-514注射(2.0mg/cm2),兩側大腿注射總面積合計不超過160平方公分。注射間隔為4週,並於最後一次注射後4週與12週評估療效與安全性。
CBL-514 產品研發現況
CBL-514注射劑是全球首創的505(b)(1)全新小分子新藥,透過誘導脂肪細胞凋亡來減少注射部位脂肪。CBL-514為一多適應症之首見新藥(First-in-class),包含非手術局部減脂(non-surgical fat reduction)、罕見疾病竇根氏症(Dercum’s disease)及中/重度橘皮組織等適應症。
CBL-514 在醫美-非手術局部減脂 (減少皮下脂肪),已於澳洲與美國完成Phase 1、Phase 2a、CBL-0202 2 Stage Phase 2以及最大劑量代謝物鑑定MetID Phase 2臨床試驗(CBL-0203 Phase 2),並皆已取得臨床統計結果。根據上述已完成的臨床試驗結果,CBL-514可明顯減少治療部位皮下脂肪,療效達顯著統計差異(p<0.00001),且單次治療即可顯著減少治療部位皮下脂肪(p<0.00001),並可在2週內看到治療效果,且治療劑量達800 mg其藥物安全性與耐受度依然良好; CBL-0204 Phase 2b臨床試驗已於美國與澳洲完成收案,預計將於2024Q2完成試驗;CBL-0205 Phase 2b 臨床試驗已於2023年10月開始收案,預計將於2024Q3完成試驗;全球多國多中心CBL-0301 Phase 3樞紐試驗IND已於2024年1月取得澳洲HREC核准執行。
CBL-514治療罕見疾病竇根氏症之CBL-0201DD Phase 2臨床試驗已於2023年4月完成試驗,其主要療效指標與次要療效指標在ITT與PP皆達到臨床及統計上顯著有效意義(p<0.0001);CBL-0202DD則預計於2024Q2開始收案。
CBL-514改善中/重度橘皮組織之CBL-0201EFP Phase 2-Stage 1已於2023年5月完成試驗並已取得療效初步統計結果,CBL-0201EFP Phase 2-stage 2已於2024年1月完成試驗,並於2024年4月取得臨床統計結果,其主要療效指標與次要療效指標在ITT與PP皆達到臨床及統計上顯著有效意義(p<0.0001)。
聲明
本文章及網站中所發佈之相關資料含有預測性敘述,此類敘述是基於現況的預測和評估。這些預測性敘述將受不確定性、風險與其他非本公司所能掌控等因素影響。惟仍存有許多因素可能使事件的發展或其實際結果與預測性敘述有重大差異。本公司不負任何更新或修訂之責任。


